近日,西安交大机械结构强度与振动国家重点实验室张磊教授团队与山东大学、国家蛋白质中心等单位合作,采用冷冻电镜技术在粘附类G蛋白偶联受体激活通用机制方面取得重大进展。
粘附类G蛋白偶联受体(Adhesion G Protein-coupled receptor,aGPCR)是GPCR超家族中的一类,共33个成员,在组织发育、生殖、神经、心血管和内分泌等多方面发挥重要的调控作用,且aGPCR突变或表达异常与生殖、神经发育或神经行为障碍、肿瘤、肌肉骨骼疾病等直接相关,但aGPCR激活机制尚不十分清楚,有效干预手段欠缺,为理解和研究粘附类受体的信号转导和功能以及相关疾病防治带来重大阻碍。
与GPCR家族其他成员相比,aGPCR具有显著的结构特征,包括复杂的多结构域的N端胞外区域(Extracellular region)以及可以发生自水解的GPCR蛋白酶自水解诱导(GPCR autoproteolysis-inducing, GAIN)结构域,其中包含保守的GPCR水解位点(GPCR proteolysis site,GPS)。绝大多数aGPCR成员可以自发在GPS位置发生自水解,产生α和β两个亚基,其中α亚基为细胞外区域(NTF),β亚基为包含七次跨膜螺旋区域(CTF),水解后的NTF与CTF在细胞表面保持非共价相连。aGPCR自水解后,其β亚基最N端的区域被称为Stachel序列(德文中的“针刺”)。研究表明aGPCR可以感受外界多种不同信号刺激而具有截然不同的激活模式,例如可以被细胞内液体流动或者震动等机械力激活,被可溶的小分子或者蛋白配体激活等。
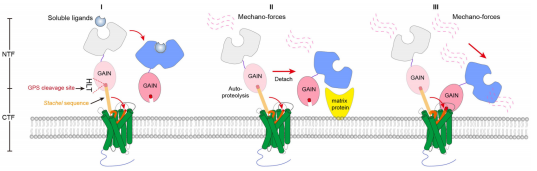
aGPCR与Stachel序列相关的激活模式
除小分子配体直接激活之外,目前认为aGPCR与Stachel相关的激活主要分为三种模式:第一种模式,可溶性配体(小分子或细胞外蛋白)的结合引起细胞外结构域的构象变化,促进Stachel序列与aGPCR的7次跨膜区域(7TM)之间的相互作用;第二种模式,在GPCR自水解位点(GPS, HLT)自水解之后,基质蛋白的结合或机械作用可能导致α亚基和β亚基的分离,这暴露了Stachel序列,Stachel与7次跨膜(7TM)束结合,最终以Stachel独立的方式激活下游信号;第三种模式,机械力诱导细胞外的结构域发生构象变化,使Stachel序列暴露,Stachel与7次跨膜(7TM)束结合并激活受体。
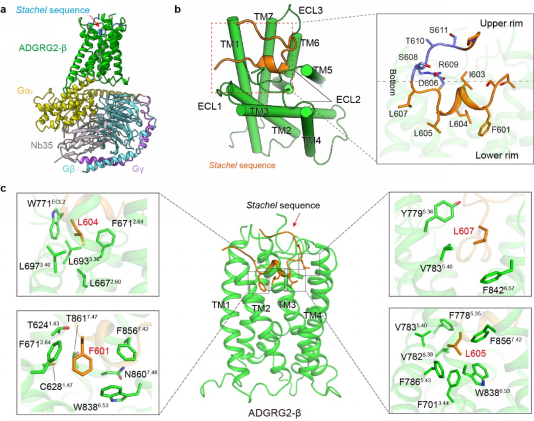
Stachel序列与ADGRG2的相互作用模式
a. Stachel序列激活的ADGRG2-β-Gs复合物结构模型。
b.Stachel序列成“U”型构型结合于ADGRG2七次跨膜螺旋形成的口袋中,并且沿底部开口方向分割为极性亲水的上半部分和疏水的下半部分。
c.Stachel序列的疏水部五个疏水氨基酸指状形式和位置与受体五个疏水口袋直接相互作用。
Stachel序列引起的粘附类GPCR激活作用一直是粘附类GPCR信号和功能的核心内容,虽然已有文献报道Stachel序列与粘附类受体的功能发挥密切相关,然而Stachel序列如何与受体作用,调控受体激活状态的通用机制仍未明晰。基于此,联合团队通过冷冻电镜技术解析了Stachel序列激活的ADGRG2-β-Gs和ADGRG4-β-Gs复合物结构,揭示了Stachel序列与aGPCR的直接作用机制。结果显示,ADGRG2和ADGRG4的Stachel序列呈“U”型形态结合在受体七次跨膜螺旋形成的口袋中,并且沿“U”型开口和底部的中线分割,分为溶剂暴露的亲水部分(Upper rim)和插入并与受体7TM形成强烈的疏水作用的疏水部分(Lowner rim)。Stachel序列的疏水部分五个疏水氨基酸Fss03,I/Vss05,Lss06,L/Mss07和Lss09呈手指状形式并与受体五个疏水口袋接触,结合生物化学实验,说明这种疏水作用模式是Stachel序列激活ADGRG2-β和ADGRG4-β所必需的。进一步的序列比较分析发现,aGPCR家族的Stachel序列上存在高度保守的F/Y/LXφφφXφ疏水结构基序(X代表任意氨基酸,φ表示疏水氨基酸)。同时结构模拟分析显示,该疏水基序在其他aGPCR中以类似ADGRG2-β和ADGRG4-β的指状作用模式和受体形成强疏水作用。生化实验也证明影响疏水作用的氨基酸突变可显著降低aGPCR的激活能力。研究详细阐明了Stachel序列激活aGPCR的通用机制,发现了5个疏水氨基酸呈手指状分布,在Stachel序列介导的激活过程中起到了主要作用,提出了aGPCR激活的“finger”模型激活模式,并命名为手指模型。
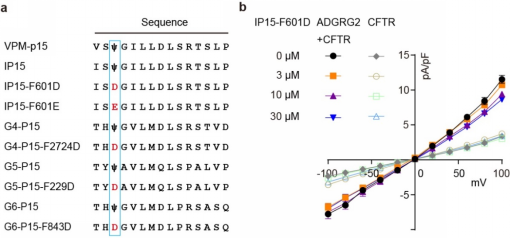
发展aGPCR通用的肽拮抗剂改造策略
目前关于aGPCR家族的拮抗剂报道甚少,制约着aGPCR家族功能的研究和相关靶向药物的开发。利用新开发的激动剂VPM-IP15,在W6.53附近的三个“手指”残基做了一系列突变,在生化验证中发现IP15中Fss03替换为D/E的负电改造可以消除ADGRG2的Gs活性,同时又与受体保持着高亲和力,并且这两个衍生肽可显著抑制ADGRG2的激活活力,同时也能抑制ADGRG2介导的CFTR钙流响应。这种通过多肽激动剂进行负电改造获得多肽拮抗剂的策略,如同在激活的手指模型的大拇指上戴了个戒指,决定性地改变了粘附类受体多肽的功能,且此方法在ADGRG4、ADGRG5和ADGRG6中也同样适用。本研究针对Fss03进行极性改造,开发了一种aGPCR家族拮抗性短肽配体的通用改造方法,将极大推动aGPCR家族多肽拮抗剂的发展。
该研究详细阐明了aGPCR自激活的分子机制,根据所观察到的Stachel基序激活机制,提出了aGPCR激活的手指模型,并在这个模型的基础上,发展了aGPCR多肽激动剂/拮抗剂设计的通用方法,对靶向aGPCR的配体药物研发有重要的参考价值和指导意义。
4月13日,该研究相关成果以“Tethered peptide activation mechanism of the adhesion GPCR ADGRG2 and ADGRG4”为题在线发表在《自然》(Nature)上。其中冷冻电镜与结构解析等相关工作由西安交大完成,西安交大张磊教授团队博士研究生緱璐为论文共同第一作者,张磊教授与山东大学第二医院/高等医学研究院孙金鹏教授、基础医学院于晓教授,上海蛋白质中心孔亮亮为共同通讯作者。该项工作获得了国家自然科学基金、中央高校基本科研业务费、中央高校建设世界一流大学(学科)和特色发展引导专项、西安交大青年拔尖人才支持计划等资助,相关表征和测试得到了分析测试共享中心软物质冷冻电镜等平台和大型设备的强力支撑。
这是继2021年5月机械结构强度与振动国家重点实验室刘益伦教授团队相关成果发表在《科学》上之后,国家重点实验室在智能软物质研究方向取得的又一重要基础研究成果。
文章链接:https://www.nature.com/articles/s41586-022-04590-8
编辑/韩 阳